
Identificación UDI (Unique Device Identification) de forma sencilla
Con el pack completo llave en mano de TRUMPF rotulará los productos médicos de forma permanente y segura  gracias al láser y al software del mismo proveedor. Cada vez más productos de tecnología médica exigen contar con una rotulación clara del código UDI (UDI = Unique Device Identification) que posibilite la trazabilidad a lo largo de toda la cadena de suministro. El requisito previo más importante: el etiquetado debe ser legible de manera permanente, una característica que normalmente solo se consigue con el marcado por láser.
¿Qué significa UDI (Unique Device Identification)?
El Unique Device Identification (UDI) es un sistema internacional unificado para la identificación de los productos médicos. El marcado del UDI consta de dos partes: un código legible por máquinas y otro legible para las personas. La parte legible por la máquina se representa como un código de barras lineal o como un código Datamatrix bidimensional, y la parte legible por el ser humano en forma de números y letras.
En tecnología médica, la seguridad del paciente es prioritaria. En este caso, es fundamental una identificación clara y homogénea de los productos médicos, desde el fabricante pasando por el comercio especializado y el hospital hasta llegar al paciente. De esta manera, se garantiza la completa transparencia en la cadena de suministro. Los responsables del aprovisionamiento y la administración del material pueden hacer referencia a los requisitos oficiales depositados en las bases de datos centrales gracias al Unique Device Identifcation. Un ejemplo de ello son el número de serie o la fecha de caducidad. Cuando se marca un producto médico como «conforme a UDI», ya no se necesitan más datos. En un futuro más o menos próximo, los productos médicos de todas las clases de riesgo tendrán que contar con una identificación clara y legible por máquinas.
Todos los productos sanitarios destinados a la venta en los Estados Unidos, así como en el mercado europeo, deberán estar marcados con un código UDI. El objetivo está claro: un sistema UDI uniforme a escala internacional. Por este motivo, el sector de la tecnología médica puede recomendar en todos los mercados que sus productos dispongan de códigos UDI, y adelantarse de este modo a las disposiciones legales.
La identificación UDI de los productos médicos se realiza sobre la base de algunas normas. La Food and Drug Administration estadounidense (FDA; Administración de Alimentos y Medicamentos) ha acreditado las normas HIBC, GS1 e ISBT 128. Fundamentalmente, la identificación consta siempre de dos partes: el DI (Device Identifier) y el PI (Production Identifier). El DI idéntico de cada artículo incluye en principio el número de identificación del productor y el etiquetador, además del código de referencia del producto correspondiente. Por el contrario, el PI es dinámico y contiene, por ejemplo, información como la fecha de caducidad y fabricación o el número de serie. La red de intercambio de datos internacional GUDID permite a los fabricantes transmitir información sobre el producto a la base de datos de UDI de la FDA estadounidense.
A diferencia de la normativa estadounidense de la FDA, la UE introdujo sobre la base de la MDR (European Union Medical Device Regulation) de la UE una nueva identificación: el «UDI-DI básico». Este permite la agrupación de los productos médicos con características semejantes en la base de datos EUDAMED de la UE. La expedición la debe realizar el fabricante del producto médico o un apoderado, antes de que el producto se presente ante las autoridades competentes para su autorización.
Encontrará toda la información relativa a las disposiciones estadounidenses en el sitio web de la autoridad estadounidense FDA.
En el sitio web de la UE MDR, encontrará una recopilación de toda la regulación europea relevante.
Todo de un solo proveedor: con los láseres de marcado y las soluciones de software de TRUMPF para el correcto marcado UDI
Además de una amplia gama de láseres de marcado, TRUMPF ofrece también soluciones de software personalizables para que los clientes creen un marcado UDI correcto a partir del contenido de sus sistemas de bases de datos y lo apliquen en el producto médico, con la posibilidad de obtener los controles de calidad y la documentación correspondientes, si así se solicita. Con este pack completo, los clientes de TRUMPF no solo obtienen una calidad de rotulación de máxima fiabilidad, sino que además se benefician de las soluciones de TRUMPF para la rotulación conforme a UDI y la seguridad de los procesos.
Con nuestras soluciones de rotulación láser, aseguramos la conformidad con UDI del año 2020 en adelante.
Envíe los DI y PI a TruTops Mark a través de la conexión de la base de datos para generar automáticamente un código de barras UDI para el marcado láser.
Con nuestro sistema de procesamiento de imágenes VisionLine Mark podrá detectar, registrar y verificar fácilmente el contenido de UDI.
Verifique el contenido marcado por láser y realice una clasificación individual de la calidad para reducir los tiempos de salida.
TRUMPF es el Solution Partner reconocido de GS1. GS1 es una de las cuatro autoridades que desarrolla y asigna códigos UDI según normas acreditadas para garantizar la trazabilidad de los productos sanitarios.
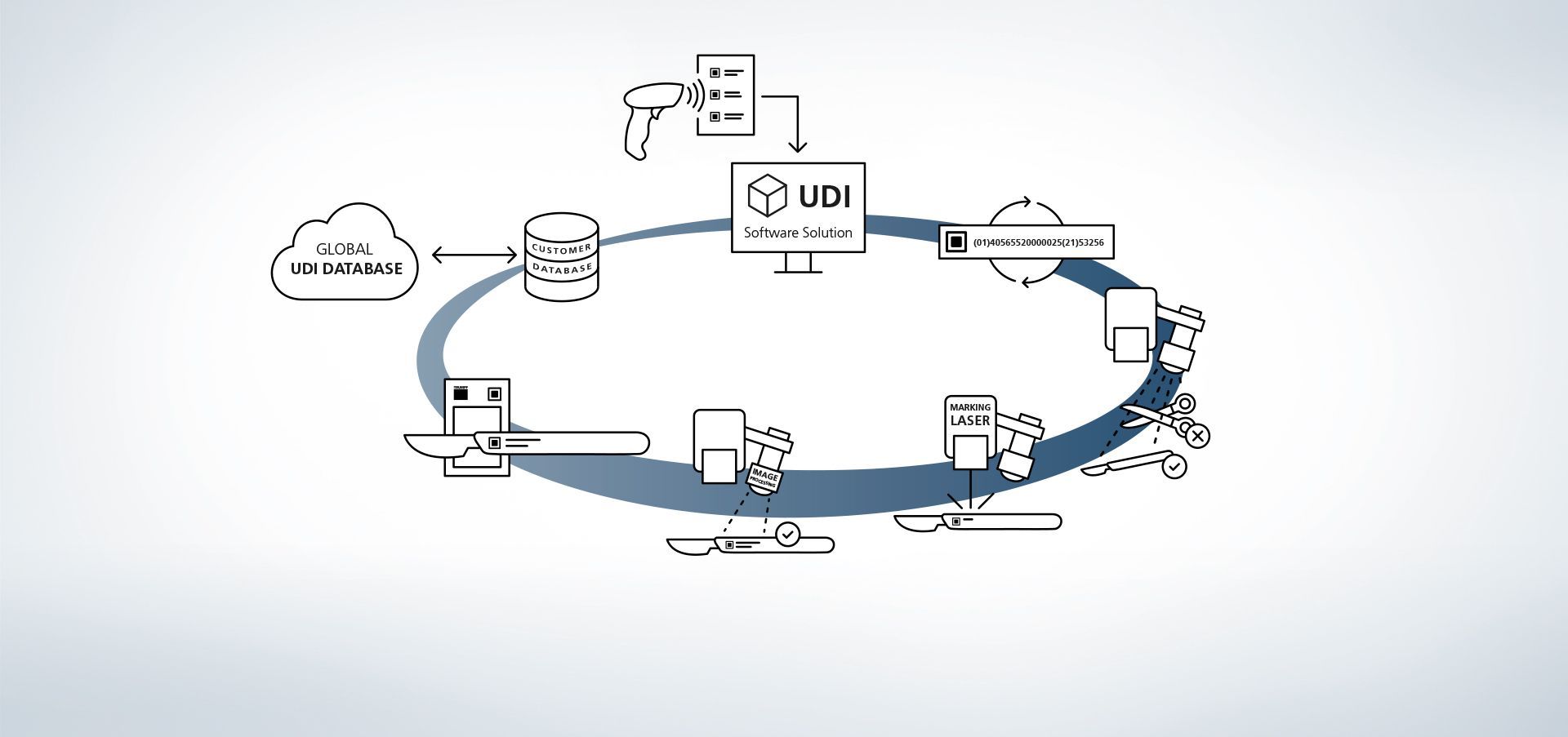
1. Acceso a la base de datos
El software está vinculado a la base de datos. Además, también es posible leer información del sistema mediante escáneres manuales externos.
2. Introducir datos de producción
Los datos están disponibles en una base de datos o se leen mediante un escáner manual.
3. Crear código UDI
El módulo UDI crea un código conforme a las normas a partir de datos relevantes para UDI y ampliaciones individuales.
4. Detección de componentes y detección de posición
Los programas de procesamiento de imágenes VisionLine Detect o VisionLine Model detectan automáticamente el componente y su posición exacta. El software transmite la información al mando que aplica el marcado en el punto adecuado.
Más información5. Uso del láser de marcado
El láser TRUMPF marca la pieza con un marcado duradero, resistente a la corrosión y con contrastes fuertes, que sigue siendo legible con máquinas y reconocible al ojo humano tras varios ciclos de limpieza.
6. Opcional: registrar el contenido del código
El control de calidad posterior también resulta muy sencillo con ayuda de la unidad de sensores de procesos de TRUMPF. Por ejemplo, la solución de procesamiento de imágenes de TRUMPF VisionLine Code puede detectar y leer códigos conformes a UDI y evaluar su calidad mediante diversos procesos.
Más información7. Opcional: cotejar datos de marcado
Con la ayuda de los programas de procesamiento de imágenes VisionLine OCR (para el reconocimiento de caracteres) o VisionLine Code (para los códigos 1D/2D) los datos marcados pueden compararse con la base de datos y almacenarse para su documentación; si se desea, también con información adicional, por ejemplo, sobre el contenido y la evaluación de la calidad del código UDI o sobre las máquinas implicadas en el proceso. De esta manera, también se garantiza la documentación de los componentes y su marcado tras varios años.
Más información



![[Translate to es_INT:]](/filestorage/TRUMPF_Master/_processed_/6/d/csm_Industry-MedTech-keyvisual_e61b5c909b.jpg)