
L'Unique Device Identification (UDI) en toute simplicité
Avec le pack complet clé en main de TRUMPF, marquez les dispositifs médicaux de manière fiable et durable grâce à un laser et à un logiciel d'une même provenance. Aujourd'hui, de plus en plus de produits de technologie médicale doivent être dotés d'un code UDI (Unique Device Identification) unique, garantissant une traçabilité sur l'ensemble de la chaîne de livraison. Conditions principale : le marquage doit être durablement lisible – une caractéristique que le marquage laser est souvent le seul à pouvoir offrir.
Qu'est-ce que l'Unique Device Identification (UDI) ?
L'Unique Device Identification (UDI) désigne un système d'identification des dispositifs médicaux unique à l'échelle mondiale. Le marquage UDI se compose de deux parties : un code lisible par la machine et un autre lisible par les êtres humains. La partie lisible par la machine peut prendre la forme d'un code-barres linéaire ou d'un code Data Matrix 2D. La partie lisible par l'homme peut être représentée sous forme de chiffres et de lettres.
En technologie médicale, la sécurité du patient est toujours au centre des préoccupations. Le marquage unique et continu des dispositifs médicaux, du fabricant jusqu'au patient en passant par le commerce spécialisé et le secteur hospitalier, constitue la base de cette démarche. Une transparence totale de la chaîne d'approvisionnement est ainsi obtenue. Grâce à la Unique Device Identification, les responsables de l'approvisionnement et de la gestion de stocks peuvent se référer aux normes réglementaires, qui sont mémorisées dans des bases de données centrales. Les données concernées sont par exemple le numéro de série ou la date de péremption. Lorsqu'un dispositif médical est marqué comme « conforme UDI », aucune indication supplémentaire n'est nécessaire. Dans un proche avenir, les dispositifs médicaux de toutes les classes de risque devront disposer d'un marquage unique et lisible par la machine.
Tous les dispositifs médicaux destinés à la vente sur le marché américain et le marché européen doivent être dotés d'un code UDI. L'objectif est clair : un système UDI unique à l'échelle mondiale. C'est pourquoi le secteur de la technologie médicale, sur tous les marchés, serait bien avisé de doter ses produits de codes UDI – et d'avoir ainsi un temps d'avance sur les prescriptions légales.
Le marquage UDI des dispositifs médicaux s'effectue sur la base de certaines normes. Aux Etats-Unis, la Food and Drug Administration (FDA ; administration chargée des produits alimentaires et pharmaceutiques) a accrédité à cet effet les normes HIBC, GS1 et ISBT 128. Le marquage se compose systématiquement de deux parties : le « DI » (Device Identifier) et le « PI » (Production Identifier). Le DI, identique pour tous les articles, contient essentiellement l'identifiant du producteur ou de l'étiqueteur, ainsi que le code de référence du produit concerné. Inversement, le PI est dynamique et contient par exemple des informations telles que les dates de fabrication et de péremption ou le numéro de série. Le réseau mondial d'échange de données GUDID permet aux fabricants de transmettre des informations produit à la base de données UDI de la FDA.
A la différence de la réglementation FDA américaine, l'UE a introduit une nouvelle appellation sur la base du règlement européen sur les dispositifs médicaux (EU MDR) : « Basic UDI-DI ». Celle-ci permet de grouper les dispositifs médicaux présentant des caractéristiques similaires dans la base de données d'homologation européenne EUDAMED. L'appellation doit être attribuée par le fabricant du dispositif médical ou par un organisme habilité par ce dernier, avant que le dispositif puisse être soumis aux autorités compétentes pour autorisation.
Vous trouverez toutes les informations relatives à la réglementation américaine directement sur le site Internet de l'administration américaine US FDA.
Le site Internet de l'EU MDR regroupe toutes les réglementations européennes importantes.
Tout en un : lasers de marquage et solutions logicielles de TRUMPF pour un marquage UDI correct
Outre une large gamme de lasers de marquage, TRUMPF propose également des solutions logicielles personnalisables, qui permettent aux clients de créer un marquage UDI correct à partir des contenus de leurs systèmes de base de données et de l'inscrire sur le dispositif médical – ils peuvent même ajouter des étapes de contrôle qualité et de documentation s'ils le souhaitent. Ce pack complet permet donc aux clients de TRUMPF, non seulement de bénéficier d'une qualité de marquage élevée et fiable, mais également de disposer des solutions TRUMPF pour le marquage conforme à la norme UDI et la fiabilité de process.
Grâce à nos solutions de marquage laser résistant à la passivation, assurez votre conformité UDI pour 2020 et au-delà.
Etablissez une connexion à votre base de données pour envoyer des DI et des PI à TruTops Mark, lequel générera automatiquement un code-barres UDI pour le marquage laser.
Notre traitement d'image VisionLine Mark vous permet d'identifier, de lire et de contrôler simplement des contenus UDI.
Contrôlez le contenu du marquage laser et classez-le individuellement dans une catégorie de qualité afin de réduire les temps de validation.
TRUMPF est agréé partenaire solution GS1 GS1 fait partie d'un groupe de quatre organismes qui développent et attribuent des codes UDI selon des normes accréditées pour assurer la traçabilité des dispositifs médicaux.
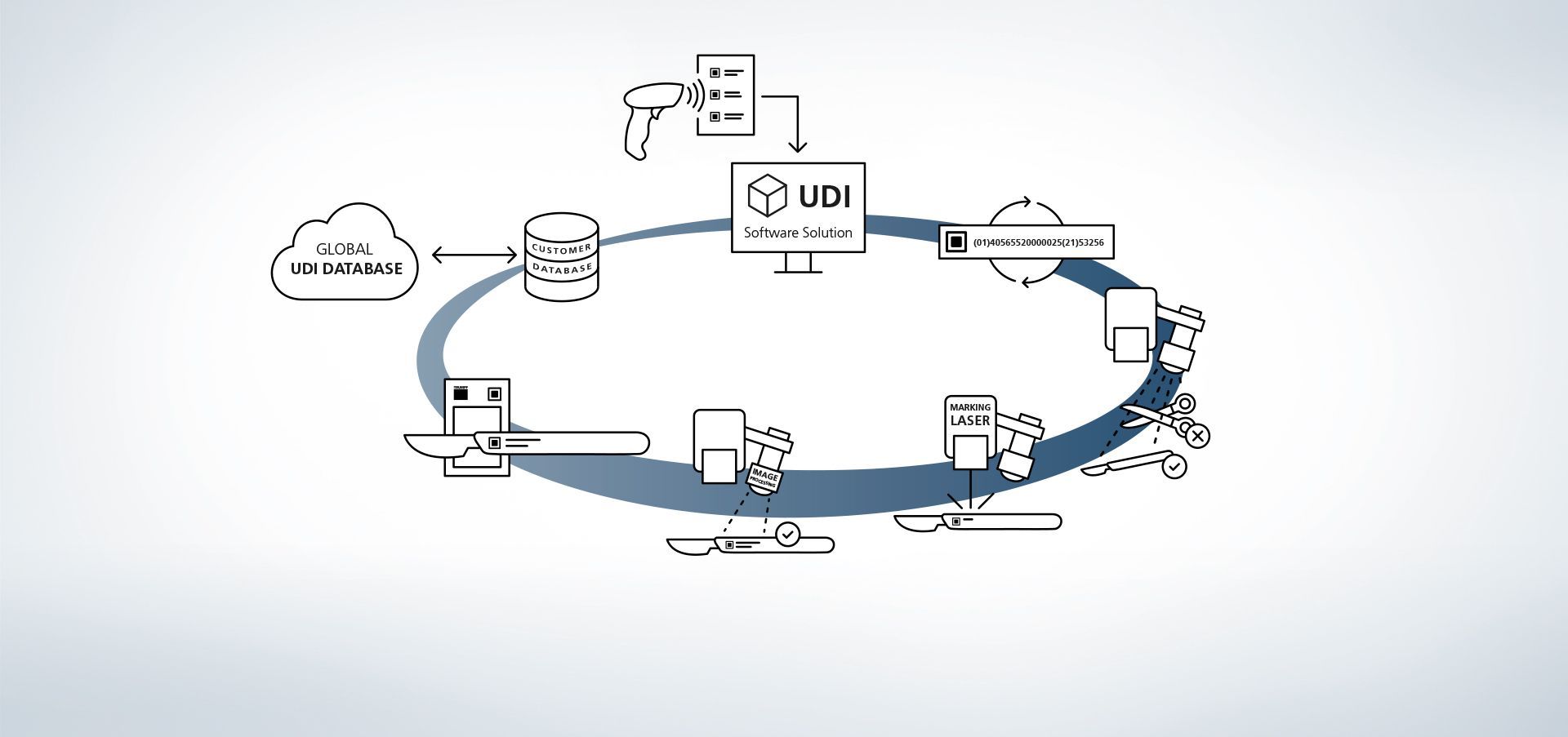
1. Accès à une base de données
Le logiciel est connecté à des bases de données. Il est également possible d'entrer des informations dans le système par exemple à l'aide d'un scanner manuel.
2. Entrer des données de production
Les données sont disponibles depuis la base de données ou sont relevées à l'aide d'un scanner manuel.
3. Création d'un code UDI
Le module UDI crée un code conforme à la réglementation à partir des données UDI et d'extensions personnalisées.
4. Reconnaissance du composant et de sa position
Les programmes de traitement d'images VisionLine Detect ou VisionLine Model reconnaissent automatiquement le composant ainsi que sa position et sa localisation précises. Le logiciel transmet les informations à la commande, qui réalise le marquage à l'emplacement correct.
En savoir plus5. Utilisation du laser de marquage
Le laser TRUMPF crée sur la pièce un marquage durable, très contrasté et résistant à la corrosion, qui demeure lisible par la machine et distinguable par l'œil humain après d'innombrables cycles de nettoyage.
6. En option : lecture du contenu du code
Le contrôle qualité qui suit le marquage est lui aussi très simple à effectuer grâce aux capteurs de process TRUMPF. La solution de traitement d'image TRUMPF VisionLine Code permet en effet d'identifier les codes conformes UDI, de les lire et d'évaluer leur qualité au moyen de différents procédés.
En savoir plus7. En option : comparaison des données de marquage
À l'aide des programmes de traitement d'image VisionLine OCR (pour la reconnaissance de caractères) ou VisionLine Code (pour les codes 1D_2D), les données marquées peuvent être comparées à celles de la base de données, puis enregistrées à des fins de documentation – éventuellement avec des informations supplémentaires, par ex. sur le contenu et l'évaluation de la qualité du code UDI ou sur les machines utilisées lors du processus. La documentation des composants et de leurs marquages est ainsi garantie, même après de nombreuses années.
En savoir plus



![[Translate to fr_CH:]](/filestorage/TRUMPF_Master/_processed_/6/d/csm_Industry-MedTech-keyvisual_e61b5c909b.jpg)