
Unique Device Identification (UDI) semplificata
Il pacchetto completo chiavi in mano di TRUMPF permette di marcare prodotti medicali in modo definitivo e in sicurezza di processo, grazie al laser e al software di un solo produttore. Oggi sempre più prodotti del settore tecnica medicale devono essere marcati con un codice UDI (UDI = Unique Device Identification) univoco e tracciabile lungo l'intera catena di produzione. Il presupposto più importante è che l'identificazione rimanga sempre leggibile: una proprietà che spesso può essere ottenuta soltanto con la marcatura laser.
Cosa significa Unique Device Identification (UDI)?
La Unique Device Identification (UDI) designa un sistema unitario applicato in tutto il mondo per identificare i prodotti in campo medico. L'identificazione UDI è composta da due parti: un codice leggibile a macchina e uno leggibile dall'occhio umano. La parte leggibile a macchina è rappresentata da un codice a barre lineare o da un Data Matrix Code 2D, mentre la parte leggibile dall'uomo è composta da numeri e lettere.
Nella tecnica medicale la sicurezza del paziente occupa il primo posto. Il punto di partenza per ottenerla è un'identificazione corretta e univoca dei prodotti medicali: dal produttore al rivenditore specializzato e all'ospedale, fino al paziente. In questo modo si assicura una trasparenza totale nella catena di approvvigionamento. I responsabili degli acquisti e della gestione del materiale possono fare riferimento alle specifiche archiviate nelle banche dati ufficiali proprio grazie all'Unique Device Identification. Ne sono esempio il numero di serie o la data di scadenza. Se un prodotto medicale è marcato come "conforme allo standard UDI", non sono necessarie altre indicazioni. Nel breve termine, i prodotti medicali di ogni classe di rischio dovranno essere identificati in modo univoco e leggibile a macchina.
Tutti i prodotti medicali destinati alla vendita negli Stati Uniti o sul mercato europeo devono essere muniti di un codice UDI. L'obiettivo è chiaro: creare un sistema UDI unitario per tutto il mondo. Per questo motivo il settore della tecnica medicale di tutti i mercati può ritenersi avvisato della necessità di fornire codici UDI ai suoi prodotti, e così ottemperare alle disposizioni legislative.
L'identificazione UDI dei prodotti medicali si basa su determinati standard. La U.S. Food and Drug Administration (FDA; ente per la regolamentazione dei prodotti alimentari e farmaceutici) ha accreditato al riguardo gli standard HIBC, GS1 e ISBT 128. L'identificazione è composta da due parti essenziali: il "DI (Device Identifier) e il "PI" (Production Identifier). Il DI identico per ogni articolo contiene in linea di principio l'ID del produttore o dell'etichettatore, nonché il codice di riferimento del rispettivo prodotto. Il PI è invece dinamico e contiene, ad esempio, informazioni come la data di scadenza e di produzione oppure il numero di serie. La rete di interscambio dati mondiale GUDID permette ai produttori di inviare le informazioni sui prodotti alla banca dati UDI americana dell'FDA.
Diversamente dal Regolamento della FDA statunitense, l'UE ha introdotto una nuova identificazione, basata sul Regolamento dell'Unione europea sui dispositivi medici (EU MDR): la "Basic UDI-DI". Questa identificazione permette di raggruppare i prodotti medicali con caratteristiche simili nel database europeo sui dispositivi medici EUDAMED. L'assegnazione deve essere effettuata dal produttore del prodotto medicale o da un mandatario prima che il prodotto venga inviato all'approvazione presso l'autorità di competenza.
Tutte le informazioni delle disposizioni statunitensi si trovano direttamente sul sito web dell'ente statunitense FDA.
Sul sito web dell'EU MDR sono riepilogati tutti i principali regolamenti europei.
Tutto da un unico fornitore: laser di marcatura e soluzioni software di TRUMPF per una corretta identificazione UDI
Oltre a un ampio portafoglio di laser di marcatura, TRUMPF offre anche soluzioni software personalizzabili, con le quali i clienti possono generare un'identificazione UDI corretta estrapolandola dai contenuti dei loro database, che sarà poi applicata sul rispettivo prodotto medicale, su richiesta con controllo qualità finale e documentazione. Con questo pacchetto completo, i clienti TRUMPF non solo ricevono una qualità di marcatura elevata e affidabile, ma beneficiano anche delle soluzioni TRUMPF per la marcatura conforme allo standard UDI, nonché della sicurezza di processo.
Con le nostre soluzioni di marcatura laser resistenti alla passivazione vi assicurate la conformità a UDI per il 2020 e oltre.
Tramite una connessione alla banca dati, inviare i DI e PI a TruTops Mark per generare in automatico un codice a barre UDI per la marcatura laser.
Con il nostro sistema di elaborazione immagini VisionLine Mark è possibile riconoscere, registrare e controllare in modo semplice i contenuti dell'UDI.
Controllare il contenuto della dicitura laser ed effettuare una classificazione individuale della qualità, per ridurre i tempi di autorizzazione.
TRUMPF, GS1 Solution Partner riconosciuto GS1 è uno di quattro enti che sviluppa e assegna codici UDI secondo norme accreditate per garantire la tracciabilità dei prodotti medicali.
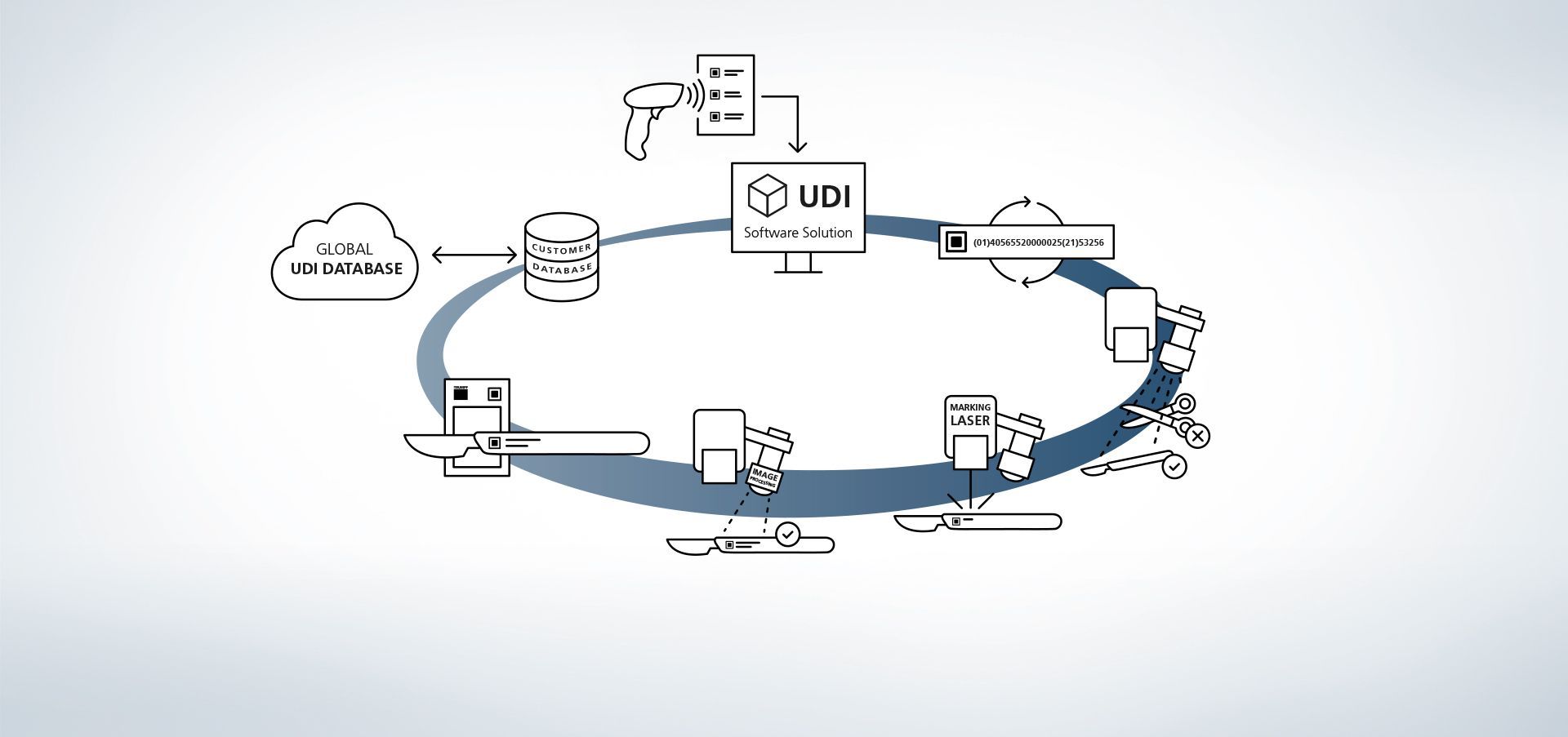
1. Accesso alla banca dati
Il software è collegato alle banche dati. È inoltre possibile, ad esempio, inserire le informazioni nel sistema leggendole con uno scanner manuale esterno.
2. Immissione dei dati di produzione
I dati sono messi a disposizione dalla banca dati o vengono letti tramite uno scanner manuale.
3. Generazione del codice UDI
Il modulo UDI genera il codice conforme alla normativa dai dati rilevanti per l'UDI e da espansioni individuali.
4. Riconoscimento di componente e posizione
I programmi di elaborazione immagini VisionLine Detect o VisionLine Model riconoscono automaticamente il componente nonché la sua esatta posizione. Il software inoltra le informazioni al controllo che posiziona la marcatura nel punto giusto.
Maggiori informazioni5. Uso del laser di marcatura
Il laser TRUMPF esegue sul pezzo una marcatura duratura, resistente alla corrosione e ben contrastata, che rimane riconoscibile anche dopo parecchi cicli di pulizia sia a macchina sia dall'occhio umano.
6. Opzionale: registrazione del contenuto del codice
Anche il controllo qualità finale è molto semplice, grazie ai sensori di processo TRUMPF. Con la soluzione di elaborazione immagini di TRUMPF VisionLine Code si possono quindi riconoscere e leggere i codici conformi allo standard UDI, nonché valutarne la qualità mediante diverse procedure.
Maggiori informazioni7. Opzionale: raffronto dei dati di marcatura
Tramite i programmi di elaborazione immagini VisionLine OCR (per il riconoscimento di caratteri) o VisionLine Code (per codici 1D/2D), è possibile confrontare i dati marcati con la banca dati e archiviarli per la documentazione – volendo anche con informazioni supplementari, come ad esempio sul contenuto e sulla valutazione qualitativa del codice UDI o sulle macchine coinvolte nel processo. Così si assicura la documentazione dei componenti e delle loro marcature anche dopo molti anni.
Maggiori informazioni



![[Translate to it_IT:]](/filestorage/TRUMPF_Master/_processed_/6/d/csm_Industry-MedTech-keyvisual_e61b5c909b.jpg)