
Unique Device Identification (UDI) eenvoudig gemaakt
Met het kant-en-klare complete pakket van TRUMPF voorziet u medische producten permanent en procesveilig van opschriften –dankzij lasers en software uit één hand. Steeds meer producten uit de medische techniek moeten vandaag de dag van een eenduidige en over de gehele leverketen traceerbare UDI-code (UDI = Unique Device Identification) voorzien zijn. De belangrijkste voorwaarde: het opschrift moet permanent leesbaar zijn – een eigenschap die vaak slechts alleen door middel van laserlabeling bereikt kan worden.
Wat betekent Unique Device Identification (UDI)?
Unique Device Identification (UDI) is een wereldwijd uniform systeem voor de identificatie van medische producten. De UDI-markering bestaat uit twee delen: een machineleesbare en een door de mens leesbare code. De machineleesbare code bestaat uit een lineaire barcode of een tweedimensionale datamatrixcode. De door de mens leesbare code bestaat uit cijfers en letters.
In de medische techniek staat de veiligheid van de patiënt voorop. Een consistente, eenduidige markering van medische hulpmiddelen vormt hier de basis – van fabrikanten en de gespecialiseerde handel tot aan het ziekenhuis en de patiënten. Op deze manier wordt voor volledige transparantie in de leveringsketen gezorgd. Dankzij Unique Device Identifcation kunnen degenen die verantwoordelijk zijn voor materiaalaankoop en materiaalbeheer de wettelijke vereisten die zijn opgeslagen in centrale databases raadplegen. Voorbeelden hiervoor zijn het serienummer of de vervaldatum. Als een medisch hulpmiddel als “UDI-conform” gemarkeerd is, zijn er geen andere gegevens meer nodig. Medische hulpmiddelen van alle risicoklassen moeten binnen afzienbare tijd van eenduidige en machineleesbare opschriften voorzien worden.
Alle medische hulpmiddelen die voor de verkoop in de Verenigde Staten en ook voor de Europese markt bedoeld zijn, moeten van een UDI-code voorzien worden. Het doel is duidelijk: een wereldwijd uniform UDI-systeem. Daarom wordt aan alle sectoren op het gebied van medische techniek in alle markten aangeraden de producten van UDI-codes te voorzien – en zo te anticiperen op wettelijke bepalingen.
Een UDI-markering van medische hulpmiddelen vindt plaats op basis van bepaalde normen. De Amerikaanse Food and Drug Administration (FDA; agentschap voor levens- en geneesmiddelen) heeft hiervoor de normen HIBC, GS1 en ISBT 128 geaccrediteerd. De markering bestaat in principe altijd uit twee delen: de “DI” (Device Identifier) en de “PI” (Production Identifier). De voor elk artikel identieke DI bevat in principe de ID van de producent of etiketteerder evenals de referentiecode van het betreffende product. De PI is daarentegen dynamisch en bevat bijvoorbeeld informatie zoals de verval- en productiedatum of het serienummer. Het wereldwijde netwerk voor gegevensuitwisseling GUDID stelt fabrikanten in staat productinformatie aan de UDI-database van de Amerikaanse FDA door te geven.
In tegenstelling tot de Amerikaanse FDA-verordening voerde de EU op basis van de verordening betreffende medische hulpmiddelen (EU MDR) een nieuw type identificatie in – “Basic UDI-DI”. Hiermee kunnen medische hulpmiddelen met vergelijkbare kenmerken in de Europese toelatingsdatabase EUDAMED gegroepeerd worden. De producent van het medische hulpmiddel of een bevoegde vertegenwoordiger dient deze toe te wijzen voordat het product ter goedkeuring aan de bevoegde autoriteiten kan worden voorgelegd.
Alle informatie over de Amerikaanse bepalingen zijn te vinden op de website van de Amerikaanse autoriteit US FDA.
Op dewebsite van de EU MDR vindt u alle belangrijke Europese regelingen samengevat.
Alles uit één hand: met markeerlasers en softwareoplossingen van TRUMPF naar de juiste UDI-markering
TRUMPF biedt naast een breed portfolio aan markeerlasers ook individualiseerbare softwareoplossingen waarmee klanten met behulp van de inhoud van hun databasesystemen een correcte UDI-markering kunnen maken en op het medische hulpmiddel kunnen aanbrengen – naar wens met aansluitende kwaliteitscontrole en documentatie. Met dit complete pakket ontvangen klanten van TRUMPF dus niet alleen de betrouwbare hoge kwaliteit, maar profiteren ze ook van de oplossingen van TRUMPF voor UDI-conforme markeringen en procesveiligheid.
Met onze passiveringsbestendige lasermarkeringsoplossingen garandeert u de UDI-conformiteit in 2020 en later.
Stuur met een databaseverbinding DI’s en PI’s naar TruTops Mark om zo automatisch een UDI-barcode voor de lasermarkering te genereren.
Met onze beeldverwerking VisionLine Mark kunt u UDI-inhoud eenvoudig herkennen, registreren en controleren.
Controleer de door de laser aangebrachte tekst en voer een individuele kwaliteitsbeoordeling uit om vrijgavetijden te reduceren.
TRUMPF is een erkende partner voor GS1-oplossingen. GS1 is een van de vier instanties die UDI-codes volgens geaccrediteerde normen ontwikkelt en uitgeeft om de traceerbaarheid van medische hulpmiddelen te waarborgen.
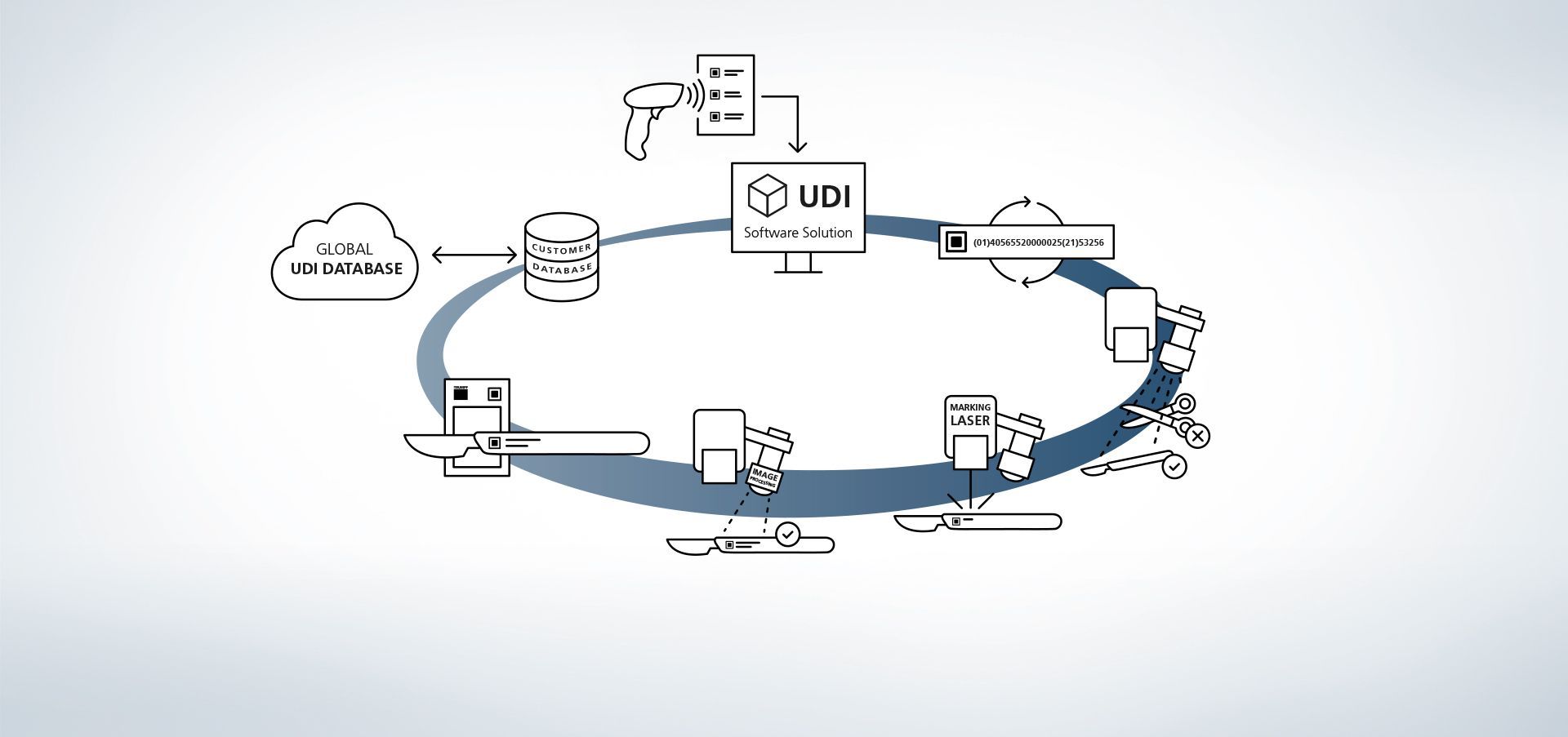
1. Toegang tot de database
De software is gekoppeld aan databases. Bovendien is het bijvoorbeeld mogelijk om via externe handscanners informatie in het systeem in te lezen.
2. Productiegegevens invoeren
De gegevens zijn via de database beschikbaar of worden via een handscanner uitgelezen.
3. UDI-code maken
De UDI-module stelt de regelconforme code op op basis van de UDI-relevante gegevens en individuele uitbreidingen.
4. Detectie van component en positie
Het beeldverwerkingsprogramma VisionLine Detect of VisionLine Model herkennen het component en de precieze locatie en positie ervan automatisch. De software stuurt de informatie door naar de besturing die de markering op de juiste plek aanbrengt.
Meer informatie5. Inzet van de markeerlaser
De laser van TRUMPF voorziet het werkstuk van een permanente, corrosiebestendige en contrasterende markering, die ook na talloze reinigingscycli nog machineleesbaar en voor het menselijke oog herkenbaar blijft.
6. Optioneel: code-inhoud registreren
Ook de aansluitende kwaliteitscontrole is dankzij de TRUMPF-processensoren zeer eenvoudig. Zo kunnen met de TRUMPF-beeldverwerkingsoplossing VisionLine Code UDI-conforme codes via verschillende procedures herkend, uitgelezen en op kwaliteit beoordeeld worden.
Meer informatie7. Optioneel: markeergegevens vergelijken
Met behulp van het beeldverwerkingsprogramma VisionLine OCR (voor tekenherkenning) of VisionLine Code (voor 1D/2D-codes) kunnen de gemarkeerde gegevens worden vergeleken met de database en ter documentatie worden opgeslagen worden – indien gewenst ook met extra informatie, bijv. over de inhoud en kwaliteitsbeoordeling van de UDI-code of via de bij het proces betrokken machines. Zo is ook na meerdere jaren de documentatie van de componenten en hun markeringen gewaarborgd.
Meer informatie



![[Translate to nl_NL:]](/filestorage/TRUMPF_Master/_processed_/6/d/csm_Industry-MedTech-keyvisual_e61b5c909b.jpg)