
Prosty sposób na Unique Device Identification (UDI)
Gotowy do użycia, kompletny pakiet firmy TRUMPF pozwala na trwałe opisywanie produktów medycznych z zachowaniem bezpieczeństwa procesu – dzięki laserowi i oprogramowaniu z jednego źródła. Coraz więcej produktów w branży techniki medycznej musi być obecnie znakowanych jednoznacznym i możliwym do prześledzenia w całym łańcuchu dostaw kodem UDI (UDI = Unique Device Identification). Najistotniejszym wymaganiem jest trwała czytelność – właściwość, którą często można uzyskać jedynie metodą znakowania laserowego.
Co oznacza Unique Device Identification (UDI)?
Unique Device Identification (UDI) to zunifikowany na całym świecie system służący do identyfikacji produktów medycznych. Oznaczenie składa się z dwóch części – z kodu maszynowego i z oznaczenia, które może odczytać człowiek. Część przeznaczona do odczytu maszynowego ma postać liniowego kodu kreskowego lub dwuwymiarowego kodu matrycowego, natomiast część przeznaczona do odczytu przez ludzi może mieć postać cyfr i liter.
Technika medyczna stawia bezpieczeństwo pacjenta na pierwszym miejscu. Trwałe, jednoznaczne oznakowanie produktów medycznych stanowi tutaj podstawę – od producentów przez handel specjalistyczny i szpital aż do pacjenta. W ten sposób zapewnia się pełną przejrzystość łańcucha dostaw. Osoby odpowiedzialne za zamawianie materiałów i gospodarkę dzięki standardowi Unique Device Identifcation mogą odnieść się do danych urzędowych, które są zapisane w centralnych bazach danych. Przykładem takich informacji są numer seryjny lub data ważności. Jeśli produkt medyczny jest oznaczony jako „zgodny z UDI”, nie ma konieczności dodatkowego znakowania. Wkrótce produkty medyczne wszystkich klas ryzyka będą musiały być oznaczone w sposób jednoznaczny i możliwy do odczytania przez maszyny.
Wszystkie wyroby medyczne przeznaczone do sprzedaży w Stanach Zjednoczonych, a także na rynku europejskim, muszą być oznaczone kodem UDI. Cel jest jasny: jednolity system UDI na całym świecie. Z tego powodu radzimy producentom z branży techniki medycznej na wszystkich rynkach naniesienie kodów UDI na produkty, aby już teraz spełniać przyszłe wymogi ustawowe.
Oznakowanie UDI produktów medycznych jest wykonywane na podstawie pewnych standardów. Amerykańska agencja Food and Drug Administration (FDA; urząd ds. produktów żywnościowych i medycznych) przeprowadziła akredytację standardów HIBC, GS1 oraz ISBT 128. Zasadniczo oznaczenie zawsze składa się z dwóch członów: „DI” (Device Identifier – identyfikator urządzenia) i „PI” (Production Identifier – identyfikator produktu). Identyczny w przypadku każdego artykułu człon DI zawiera zasadniczo identyfikator producenta lub podmiotu znakującego oraz kod referencyjny odpowiedniego produktu. W przeciwieństwie do tego człon PI zmienia się i zawiera informacje takie jak daty produkcji i ważności lub numer seryjny. Ogólnoświatowa sieć wymiany danych GUDID umożliwia producentom przekazywanie danych do amerykańskiej bazy danych kodów UDI prowadzonej przez FDA.
W przeciwieństwie do amerykańskiego rozporządzenia FDA Unia Europejska na podstawie dyrektywy o urządzeniach medycznych – European Union Medical Device Regulation (UE MDR) – wprowadziła nowe oznaczenie – „Basic UDI-DI”. Umożliwia one grupowanie produktów medycznych o podobnych cechach w europejskiej bazie danych dopuszczeń EUDAMED. Przydzielenie musi zostać wykonane przez producenta lub podmiot upoważniony zanim produkt zostanie przedstawiony odpowiednim organom w celu dopuszczenia.
Wszystkie informacje dotyczące przepisów obowiązujących w USA znajdują się bezpośrednio na stronie amerykańskiej agencji US FDA.
Na stronie UE MDR znajduje się zestawienie wszystkich istotnych europejskich dyrektyw.
Wszystko z jednego źródła: lasery znakujące i rozwiązania programowe firmy TRUMPF do prawidłowego znakowania UDI
Oprócz szerokiej oferty laserów znakujących firma TRUMPF zapewnia także oprogramowanie, dzięki czemu klienci na podstawie zawartości swoich systemów baz danych mogą opracowywać znakowanie kodem UDI i nanosić je na produkt medyczny – na życzenie z końcową kontrolą jakości i dokumentacją. Komplety pakiet pozwala klientom firmy TRUMPF nie tylko na uzyskanie stale wysokiej jakości znakowania, ale także na korzystanie z rozwiązań TRUMPF umożliwiających zapewnienie zgodności z systemem UDI oraz zagwarantowanie bezpieczeństwa procesu.
Nasze odporne na pasywację rozwiązania znakowania laserowego zapewniają zgodność z procedurami UDI, które zaczną obowiązywać w roku 2020.
Za pomocą połączenia z bazą danych można wysyłać numery DI i PI do urządzenia TruTops Mark, aby automatycznie wygenerować kod kreskowy UDI do znakowania laserowego.
Nasz program obróbki obrazów VisionLine Mark pozwala na proste odczytywanie, określanie i kontrolę oznaczeń UDI.
Treść opisaną laserem należy skontrolować, warto skorzystać z indywidualnej kwalifikacji jakości, aby obniżyć czas dopuszczenia.
Firma TRUMPF jest uznanym członkiem programu GS1 Solution Partner GS1 jest jednym z czterech organów, które opracowują i przydzielają kody UDI zgodnie z akredytowanymi standardami w celu zapewnienia identyfikowalności wyrobów medycznych.
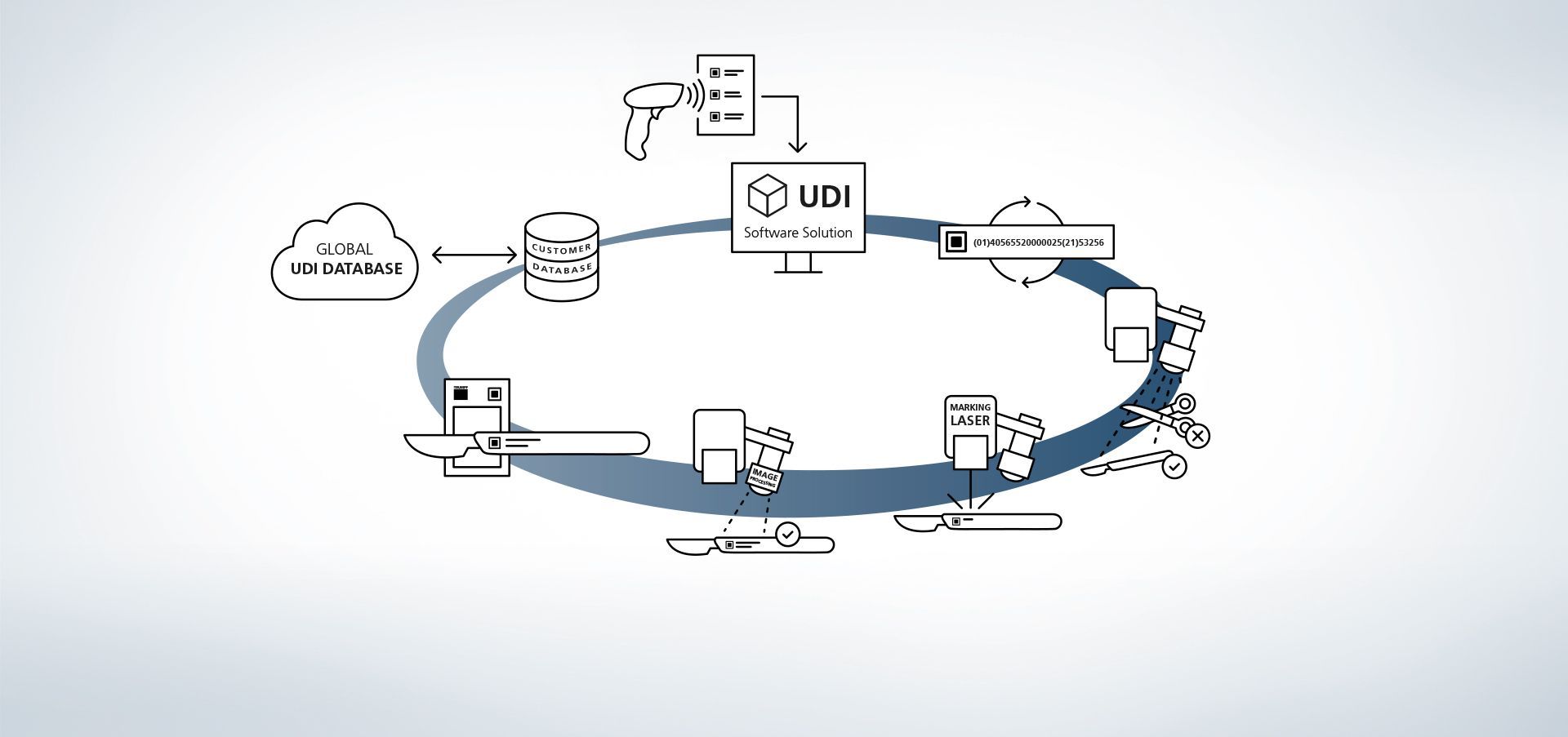
1. Dostęp do bazy danych
Oprogramowanie jest powiązane z bazami danych. Dodatkowo możliwe jest np. wczytywanie informacji do systemu np. za pomocą zewnętrznego skanera ręcznego.
2. Wprowadzanie danych dotyczących produkcji
Dane są udostępniane w bazie danych lub są wczytywane za pomocą ręcznego skanera.
3. Tworzenie kodu UDI
Moduł UDI tworzy kod spełniający wymogi na podstawie danych dotyczących UDI oraz indywidualnych rozszerzeń
4. Rozpoznawanie elementów i położenia
Programy obróbki obrazu VisionLine Detect lub VisionLine Model automatycznie wykrywają element i jego dokładne położenie. Oprogramowanie przekazuje te informacje do układu sterowania, aby oznaczenie zostało naniesione w odpowiednim miejscu.
Więcej informacji5. Zastosowanie lasera znakującego
Laser TRUMPF znakuje przedmiot obrabiany trwałym, odpornym na korozję i kontrastowym oznakowaniem, które także po wielu cyklach czyszczenia nadal jest możliwe do odczytania przez maszyny i rozpoznawalne dla człowieka.
6. Opcja: tworzenie zawartości kodu
Także późniejsza kontrola jakości jest bardzo prosta dzięki czujnikom procesowym firmy TRUMPF. Dzięki rozwiązaniu firmy TRUMPF do obróbki obrazu VisionLine Code UDI można wykrywać i odczytywać kody zgodne z wymogami oraz oceniać ich jakość za pomocą różnych metod.
Więcej informacji7. Opcja: porównanie danych znakowania
Za pomocą programów obróbki obrazów VisionLine OCR (do rozpoznawania znaków) lub VisionLine Code (do kodów 1D/2D) oznakowane dane można porównać z bazą danych i zapisać do dokumentacji – w razie potrzeby także z dodatkowymi informacjami, np. o zawartości i ocenie jakości kodu UDI lub o maszynach biorących udział w procesie. Dzięki temu nawet po wielu latach zapewniona jest przejrzystość dokumentacji części i ich oznaczeń.
Więcej informacji



![[Translate to pl_PL:]](/filestorage/TRUMPF_Master/_processed_/6/d/csm_Industry-MedTech-keyvisual_e61b5c909b.jpg)