
Unique Device Identification (UDI) leichtgemacht
Mit dem schlüsselfertigen Komplettpaket von TRUMPF markieren Sie Medizinprodukte dauerhaft und prozesssicher – dank Laser und Software aus einer Hand. Immer mehr Produkte aus der Medizintechnik müssen heute mit einem eindeutigen und über die gesamte Lieferkette rückverfolgbaren UDI-Code (UDI = Unique Device Identification) markiert sein. Wichtigste Voraussetzung: die Kennzeichnung muss dauerhaft lesbar sein - eine Eigenschaft, die oftmals nur durch Lasermarkieren erreicht werden kann.
Was bedeutet Unique Device Identification (UDI)?
Unique Device Identification (UDI) bezeichnet ein weltweit einheitliches System zur Identifikation von Medizinprodukten. Die UDI-Kennzeichnung besteht aus zwei Teilen – aus einem maschinenlesbaren und einem vom Menschen lesbaren Code. Der maschinenlesbare Anteil wird entweder als linearer Barcode oder als zweidimensionaler Datamatrix-Code dargestellt, der vom Menschen lesbare Anteil in Form von Zahlen und Buchstaben.
In der Medizintechnik steht die Patientensicherheit an erster Stelle. Eine durchgängige, eindeutige Kennzeichnung von Medizinprodukten bildet hier die Grundlage – vom Hersteller über den Fachhandel und das Krankenhaus bis hin zum Patienten. Auf diese Weise wird eine komplette Transparenz in der Versorgungskette sichergestellt. Verantwortliche in der Materialbeschaffung und Materialwirtschaft können sich dank Unique Device Identifcation auf behördliche Vorgaben beziehen, die in zentralen Datenbanken hinterlegt sind. Beispiele hierfür sind die Seriennummer oder das Verfallsdatum. Ist ein Medizinprodukt „UDI-konform“ markiert, sind keine weiteren Angaben mehr notwendig. In absehbarer Zeit werden Medizinprodukte aller Risikoklassen eindeutig und maschinenlesbar gekennzeichnet werden müssen.
Alle Medizinprodukte, die für den Verkauf in den Vereinigten Staaten sowie auf dem europäischen Markt bestimmt sind, sind mit einem UDI-Code zu versehen. Das Ziel ist klar: ein weltweit einheitliches UDI-System. Aus diesem Grund kann der Medizintechnik-Branche in allen Märkten geraten werden, ihre Produkte mit UDI-Codes zu versehen – und so gesetzlichen Bestimmungen vorweg zu kommen.
Eine UDI-Kennzeichnung von Medizinprodukten erfolgt auf Basis gewisser Standards. Die U.S. Food and Drug Administration (FDA; Behörde für Lebens- und Arzneimittel) hat hierfür die Standards HIBC, GS1 und ISBT 128 akkreditiert. Grundsätzlich besteht die Kennzeichnung immer aus zwei Teilen: dem „DI“ (Device Identifier) und dem „PI“ (Production Identifier). Der für jeden Artikel identische DI enthält prinzipiell die ID des Produzenten bzw. Etikettierers sowie den Referenzcode des jeweiligen Produkts. Im Gegensatz hierzu ist die PI dynamisch und enthält zum Beispiel Informationen wie das Verfalls- und Herstellungsdatum oder die Seriennummer. Das weltweite Datenaustauschnetzwerk GUDID ermöglicht es Herstellern Produktinformationen an die amerikanische FDA UDI-Datenbank weiterzugeben.
Im Gegensatz zu der US-amerikanischen FDA-Verordnung führte die EU auf Basis der European Union Medical Device Regulation (EU MDR) eine neue Kennung ein – „Basic UDI-DI“. Diese ermöglicht die Gruppierung von Medizinprodukten mit ähnlichen Merkmalen in der EU-Zulassungsdatenbank EUDAMED. Die Vergabe muss vom Hersteller des Medizinproduktes oder eines Bevollmächtigten vorgenommen werden, bevor das Produkt bei den zuständigen Behörden zur Zulassung eingereicht werden darf.
Alle Infos der US-amerikanischen Bestimmungen finden Sie direkt auf der Website der US-Behörde US FDA.
Auf der Website der EU MDR finden Sie alle wichtigen europäischen Regelungen zusammengefasst.
Alles aus einer Hand: Mit Markierlasern und Softwarelösungen von TRUMPF zur korrekten UDI-Kennzeichnung
TRUMPF bietet neben einem breiten Portfolio an Markierlasern auch individualisierbare Softwarelösungen, mit denen Kunden aus den Inhalten ihrer Datenbanksysteme eine korrekte UDI-Kennzeichnung erstellen und auf das Medizinprodukt aufbringen können - auf Wunsch mit anschließender Qualitätskontrolle und Dokumentation. Mit diesem Komplettpaket erhalten TRUMPF Kunden also nicht nur die zuverlässig hohe Markierqualität, sondern profitieren auch von den TRUMPF Lösungen für UDI-konforme Markierung sowie Prozesssicherheit.
Mit unseren passivierungsbeständigen Laserbeschriftungslösungen stellen Sie die UDI-Konformität im Jahr 2020 und darüber hinaus sicher.
Senden Sie mit einer Datenbankverbindung DIs und PIs an TruTops Mark, um automatisch einen UDI-Barcode für die Lasermarkierung zu generieren.
Mit unserer VisionLine Mark Bildverarbeitung können Sie UDI-Inhalte einfach erkennen, erfassen und prüfen.
Prüfen Sie den laserbeschrifteten Inhalt und nehmen Sie eine individuelle Qualitätseinstufung vor, um Freigabezeiten zu reduzieren.
TRUMPF ist anerkannter GS1 Solution Partner. GS1 ist eine von vier Behörden, die UDI-Codes nach akkreditierten Normen entwickelt und vergibt, um die Rückverfolgbarkeit von Medizinprodukten zu gewährleisten.
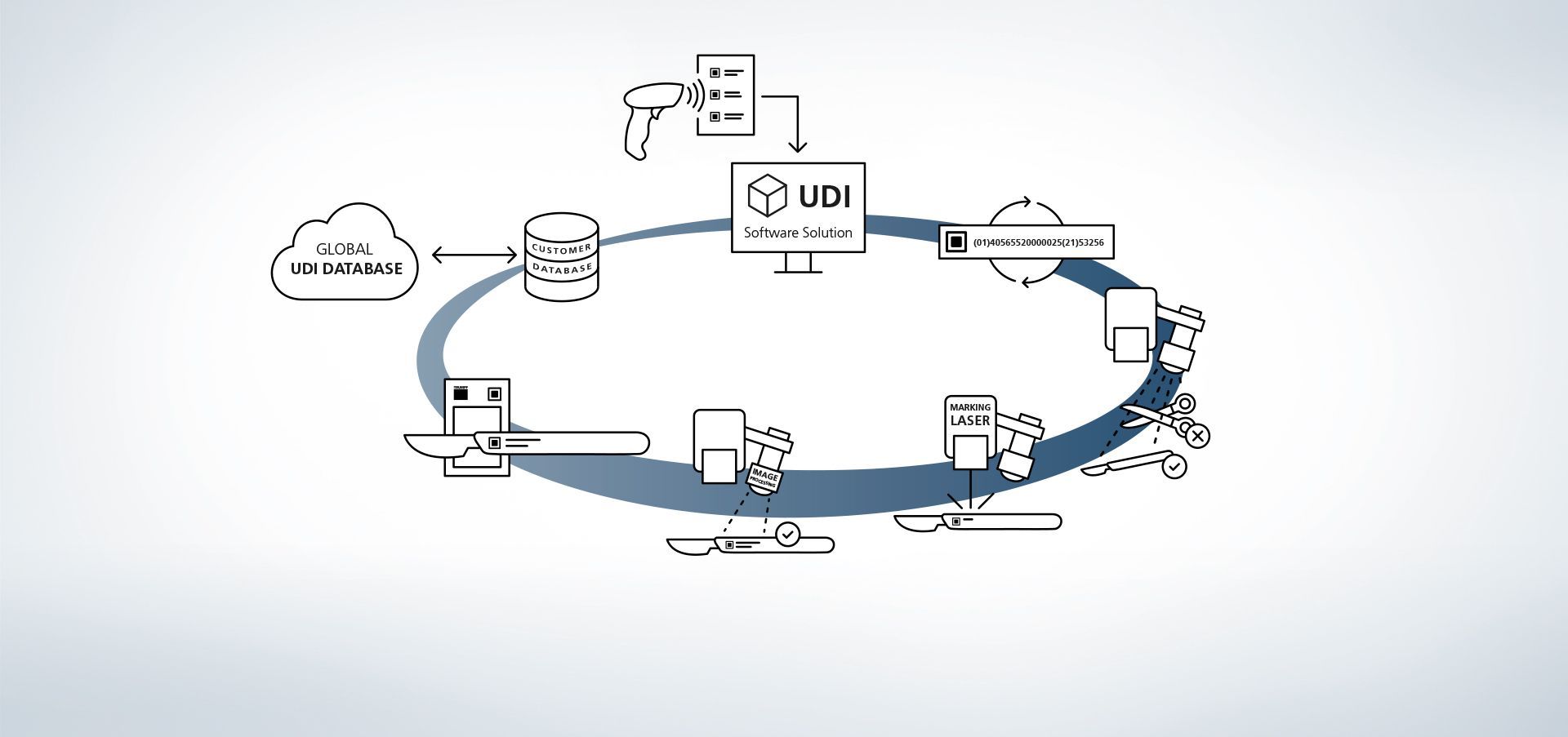
1. Zugriff auf Datenbank
Die Software ist mit Datenbanken verknüpft. Zusätzlich ist es beispielsweise möglich, über externe Handscanner Informationen in das System einzulesen.
2. Produktionsdaten eingeben
Die Daten stehen über die Datenbank verfügbar oder werden über einen Handscanner ausgelesen.
3. UDI-Code erstellen
Das UDI-Modul erstellt den regelkonformen Code aus den UDI-relevanten Daten und individuellen Erweiterungen.
4. Bauteil- und Lageerkennung
Die Bildverarbeitungsprogramme VisionLine Detect oder VisionLine Model erkennen das Bauteil sowie dessen genaue Lage und Position automatisch. Die Software leitet die Informationen an die Steuerung weiter, die die Markierung an der richtigen Stelle setzt.
Mehr Erfahren5. Einsatz des Markierlasers
Der TRUMPF Laser markiert das Werkstück mit einer dauerhaften, korrosionsbeständigen und kontrastreichen Markierung, die auch nach etlichen Reinigungszyklen noch maschinenlesbar und mit dem menschlichen Auge erkennbar bleibt.
6. Optional: Codeinhalt erfassen
Auch die anschließende Qualitätskontrolle ist mithilfe der TRUMPF Prozesssensoren sehr einfach. So lassen sich mit der TRUMPF Bilderverarbeitungslösung VisionLine Code UDI – konforme Codes erkennen, auslesen sowie deren Qualität über verschiedene Verfahren beurteilen.
Mehr Erfahren7. Optional: Markierdaten abgleichen
Mithilfe der Bildverarbeitungsprogramme VisionLine OCR (für Zeichenerkennung) bzw. VisionLine Code (für 1D/2D Codes) können die markierten Daten mit der Datenbank abgeglichen und zur Dokumentation gespeichert werden – wenn gewünscht auch mit zusätzlichen Informationen, z. B. über Inhalt und Qualitätsbeurteilung des UDI Codes oder über die im Prozess involvierten Maschinen. So ist auch nach mehreren Jahren die Dokumentation der Bauteile und deren Markierungen sichergestellt.
Mehr Erfahren



![[Translate to de_CH:]](/filestorage/TRUMPF_Master/_processed_/6/d/csm_Industry-MedTech-keyvisual_6d59f95224.jpg)